Los estándares CDISC: la fórmula del éxito para los datos clínicos
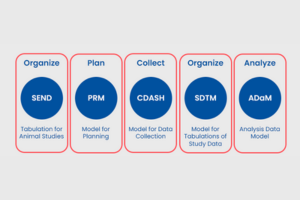
En el mundo de la investigación clínica, el intercambio y análisis de datos juegan un papel fundamental en el desarrollo de tratamientos seguros y efectivos. Los estándares CDISC (Clinical Data Interchange Standards Consortium) han demostrado ser la fórmula del éxito para lograr una armonización y estandarización efectiva en el intercambio de datos clínicos. En este artículo, exploraremos cómo los estándares CDISC han revolucionado la manera en que los datos se presentan, analizan y comparten en el ámbito de la investigación médica, mejorando la calidad de los ensayos clínicos y acelerando el progreso hacia nuevos avances terapéuticos
¡Un año más abogando por la seguridad de los pacientes!

En el día mundial de la seguridad del paciente, 17 de septiembre, recordamos una vez más, aquello que define a Sermes como CRO líder. Nos denominamos compañía Patient Centric, ya que todos y cada uno de nuestros proyectos, posicionan al paciente en el centro de la investigación.
Pago de tasas de estudios clínicos: novedades y exenciones

Conoce los cinco casos que están exentos del pago de tasas por realizar estudios clínicos, tras los cambios legislativos que afectan a las tasas sobre medicamentos, productos sanitarios, productos cosméticos y productos de cuidado personal
Transformando la investigación clínica mediante la inteligencia artificial

La incursión de la Inteligencia Artificial (IA) y el aprendizaje automático en la Investigación Clínica ha probado ser una herramienta efectiva para mejorar la eficacia de los procesos y la precisión de los resultados
Sermes CRO se suma a la iniciativa de empresas responsables con el VIH, de la mano de Trabajando en Positivo

Sermes CRO hace suyos los objetivos de Cero nuevas infecciones por VIH, Cero muertes por SIDA y Cero Discriminación, gracias a su acuerdo con Trabajando en Positivo, entidad que promueve la igualdad de oportunidades para personas con VIH
Julio Bonis, nuevo director de Inteligencia Artificial & Big Data de Sermes CRO

Reforzamos nuestro departamento de Inteligencia Artificial & Big Data con el nombramiento de su nuevo director, Julio Bonis, especialista en Inteligencia Artificial aplicada al sector sanitario
Análisis de las Autorizaciones expresas de importación de productos sanitarios

En situaciones excepcionales, los profesionales sanitarios pueden encontrarse ante la necesidad de utilizar productos sanitarios que no han obtenido el marcado CE o que van a ser utilizados en condiciones de uso distintas de las autorizadas. En este artículo, analizaremos las autorizaciones expresas de importación de productos sanitarios, la legislación aplicable a las mismas y la documentación necesaria para solicitarlas.
¡Viva la diversidad!

En la semana del orgullo LGTBI reivindicamos una vez más lo que nos define como organización: en Sermes CRO somos una empresa con alma, una compañía en la que el componente humano – y social – tienen un peso principal. Cuando decimos “viva la diversidad” no son sólo palabras. Son hechos. ¿Quieres saber por qué?
Bases de datos de Ensayos Clínicos: ¿cómo les afecta la nueva regulación europea CTR 536/2014?

Las bases de datos como ClinicalTrials.gov y REec (Registro Español de Estudios Clínicos) son fundamentales para el desarrollo y éxito de los ensayos clínicos. Estas permiten el registro y la divulgación de los ensayos clínicos en curso y sus resultados, lo que garantiza la transparencia y la accesibilidad de la información. A continuación, analizaremos en qué medida la nueva regulación 536/2014 les afectará en los próximos años y qué sucederá con EudraCT.
¿Qué es un ensayo clínico? El punto de vista del paciente

¿Qué es un ensayo clínico y para qué sirve? ¿En qué se diferencia de la práctica médica habitual? ¿Qué personas e instituciones intervienen en los ensayos clínicos? ¿Cuáles son los beneficios y los riesgos para los participantes? Desde que se inicia el desarrollo de un fármaco hasta que está disponible para pacientes y profesionales de la salud, se debe estudiar y demostrar su seguridad y eficacia y eso es precisamente lo que se persigue con la realización de ensayos clínicos