
Nuestro Blog
¿Estamos sacando partido al nuevo portal europeo de ensayos clínicos, CTIS?
Analizamos los datos de uso del CTIS en sus primeros tres meses de funcionamiento y te damos a conocer el nuevo informe que la EMA publicará periódicamente con los principales KPIs. En él se realiza un seguimiento exhaustivo del ecosistema de ensayos clínicos europeo
Por Lidya Domínguez
Regulatory Unit Head en Sermes CRO
Analizamos los datos de uso del CTIS en sus primeros tres meses de funcionamiento y te damos a conocer el nuevo informe que la EMA publicará periódicamente con los principales KPIs. En él se realiza un seguimiento exhaustivo del ecosistema de ensayos clínicos europeo
Por Lidya Domínguez
Regulatory Unit Head en Sermes CRO
Ha pasado poco tiempo desde que comenzó a funcionar el nuevo portal de ensayos clínicos europeo, CTIS (Clinical Trial Information System). Según los datos publicados por la EMA, desde la puesta en marcha del CTIS (31 de enero), hasta el 30 de abril, se presentaron 56 ensayos clínicos para su evaluación por los Estamos Miembros a través de CTIS, de los cuales se autorizaron cuatro.
La llegada del CTIS supone un absoluto cambio de paradigma para la investigación clínica que opera en Europa, puesto que tiene consecuencias tanto para los promotores como para las agencias reguladoras y los propios ciudadanos, ya sean pacientes o público en general.
- Los promotores o sponsors, una vez agotado el periodo de transición de tres años, tendrán que realizar todas las gestiones de documentación relacionadas con sus ensayos clínicos a través de CTIS.
- Las agencias reguladoras (que son el equivalente a lo que en el entorno del CTIS y la CTR se refieren como Estados Miembros) tendrán que realizar su evaluación a través de la nueva plataforma.
- El público tendrá acceso a más información sobre los ensayos clínicos, ya que esta estará disponible en la plataforma para el público en general.
Transparencia para el público y mayor confianza entre las agencias reguladoras
La publicación de la información de los ensayos clínicos es, por tanto, una de las grandes novedades de este nuevo escenario para la investigación en Europa. Los datos son visibles para pacientes, profesionales de la salud y el público en general a través de la búsqueda pública dentro de CTIS. Según ha publicado la propia EMA, “la disponibilidad pública de una cantidad sin precedentes de datos sobre ensayos individuales a través de CTIS empodera a los pacientes para encontrar ensayos de reclutamiento en su país y garantiza los más altos niveles de transparencia para los ensayos clínicos en Europa”.
También se abre un nuevo marco de estrecha colaboración – y necesidad de confianza – entre las agencias reguladoras de los diferentes Estados Miembros. Esto sucede en el caso de los ensayos multinacionales, en los que el promotor deberá “escoger” al Estado Miembro notificante, es decir, que la agencia reguladora de ese estado será la única encargada de evaluarlo. Las agencias del resto de países deberán acatar el resultado de esta evaluación.

KPIs para el seguimiento del ecosistema de ensayos clínicos europeos
Tras el gran esfuerzo llevado a cabo por la EMA y los Estados Miembro para implantar este nuevo sistema de gestión de la documentación de ensayos clínicos, es igualmente importante realizar una adecuada monitorización de los avances alcanzados. Por eso, desde el pasado mayo, la EMA publica de manera mensual un informe con los principales KPIs de esta transición. Se pueden consultar en este enlace.
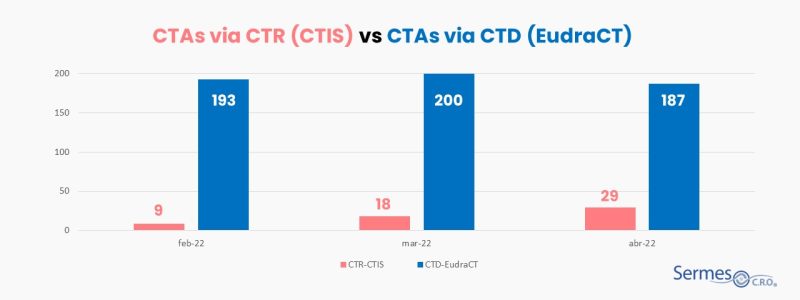
Los KPIs miden el número de solicitudes de ensayos clínicos que se han presentado a través de la CTR 536/2014 (es decir, a través de CTIS) y aquellos que se han presentado bajo la Directiva (es decir, a través de EudraCT), desde el 31 de enero de 2022. Además, el informe también ofrece datos como el número de ensayos autorizados que son mononacionales y multinacionales, comerciales y no comerciales, y el número de ensayos por fase y área terapéutica.
Los datos publicados en el primer informe de KPIs de la EMA muestran que el CTIS se está comenzando a utilizar, pero, lógicamente, las cifras de solicitud de autorización de ensayos clínicos son definitivamente más altas si nos fijamos en las cifras de la antigua Directiva. Si por el CTIS se han presentado 56 solicitudes en los tres meses estudiados (febrero/marzo/abril de 2022), a través de EudraCT se han presentado un total de 580. Es decir, que menos de un 10% del total de solicitudes se han realizado a través de la nueva plataforma.
Es lógico que la industria se tome su tiempo para adaptarse a la nueva situación, pues son muchos los documentos, procedimientos y flujos internos de trabajo que se deben modificar. De hecho, la norma prevé un periodo de transición de 3 años, a contar desde el 31 de enero de 2022. Sin embargo, también es cierto que aquellos que antes comiencen a utilizar el CTIS serán los que se verán más beneficiados del ahorro de tiempo y costes que supone esta centralización de la gestión de toda la documentación asociada a los ensayos. En Sermes CRO ya estamos trabajando con la herramienta. De hecho, el 24 de marzo ya presentamos nuestro primer ensayo por CTIS. ¡El primero de muchos!











