
Nuestro Blog
21 de diciembre de 2022
¿Cómo hacer el registro en OMS para poder trabajar dentro de CTIS?
Para poder realizar un ensayo clínico en CTIS, previamente es necesario haberse registrado en OMS. En este artículo te contamos cuál es el proceso para el registro en OMS de promotores y centros que participan en ensayos clínicos
Por Blanca Oñoro
Técnica de Documentación Clínica y Terapias Avanzadas en Sermes CRO
Para poder realizar un ensayo clínico en CTIS, previamente es necesario haberse registrado en OMS. En este artículo te contamos cuál es el proceso para el registro en OMS de promotores y centros que participan en ensayos clínicos
Por Blanca Oñoro
Técnica de Documentación Clínica y Terapias Avanzadas en Sermes CRO

Con la implantación del CTIS (el nuevo portal de ensayos clínicos europeo) como única vía para gestionar la documentación de ensayos clínicos en Europa, son muchas las novedades que debemos tener en cuenta todos los promotores, centros y CROs que nos dedicamos a la investigación clínica. Una de esas novedades es el registro previo obligatorio en OMS para poder operar dentro de CTIS
¿Qué es OMS (Organisation Management Services)?
Para poder realizar un ensayo clínico bajo el Reglamento (UE) 536/2014, los promotores del ensayo (junto con los proveedores de servicios a los que les ha delegado alguna de sus funciones), y los centros que participan en el estudio deben de estar registrados en OMS (Organisation Management Services).
OMS es un portal que contiene un diccionario con información validada sobre numerosas organizaciones. No solo incluye los nombres de las diferentes organizaciones, sino también los detalles de su ubicación e información de contacto (como la dirección de correo electrónico y el número de teléfono). A cada organización se le asigna un número, denominado el ORG-ID.
Esta plataforma permite ver, buscar, exportar datos de organizaciones, solicitar el registro de una nueva organización o actualizar los datos de una organización ya existente.
De esta forma, OMS favorece el acceso continuo y centralizado a la información validada de diversas organizaciones tales como titulares de autorizaciones de comercialización, patrocinadores, autoridades reguladoras, centros del ensayo y fabricantes.
¿Cuál es la relación entre CTIS y OMS?
Uno de los principales objetivos del Reglamento de Ensayos Clínicos consiste en armonizar la presentación, evaluación y supervisión de los procesos relacionados con los ensayos clínicos en la Unión Europea (UE) a través de un nuevo portal, denominado CTIS (Clinical Trials Information System).
Para realizar la solicitud de autorización de un ensayo, se deben incluir en CTIS los datos de las diversas organizaciones implicadas en él. CTIS obtiene los datos directamente a través de OMS. Por lo tanto, los promotores del ensayo, junto con sus proveedores de servicios (como las Organización de investigación por contrato – CRO, u otras instalaciones que participen en la realización del estudio) se habrán tenido que registrar con éxito en OMS para poder solicitar la autorización de un ensayo. Además, los centros que participan en el ensayo clínico también se deben de incluir en CTIS, y obteniéndose su información también de OMS, por lo que estos centros también se consideran organizaciones que deben registrarse en este portal.
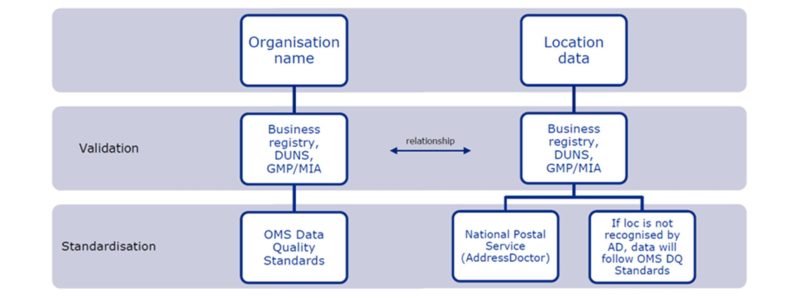
¿Qué proceso hay que seguir para registrar una organización en OMS?
Si una organización aún no está registrada en OMS cuando se empieza a utilizar CTIS, se debe realizar su registro. Hay dos formas de llevar a cabo el registro de una organización:
- Directamente en el portal de OMS.
- Mientras se trabaja en CTIS.
Independientemente de la vía que se utilice para realizar el registro, siempre hay que proporcionar la documentación necesaria que apoye el proceso (que dependerá del tipo de organización que se quiera registrar, y si la organización está o no inscrita en un registro nacional de empresas), y la solicitud tardará en validarse un máximo de 10 días laborables:
- En el caso de las organizaciones situadas en países del Espacio Económico Europeo (EEE), el nombre de la organización se validará comparándolo con el registro nacional de empresas (cuando esté disponible) y los datos (por ejemplo, el nombre de la organización) se normalizarán de acuerdo con las normas de calidad de datos de OMS.
- Para las organizaciones situadas en países no pertenecientes al EEE, el nombre de la organización se validará con el sitio web DUNS (cuando esté disponible) y los datos, como en el caso anterior, también se normalizarán de acuerdo con las normas de calidad de datos de OMS.
- Los datos de la localización de la organización serán validados y normalizados por la herramienta de verificación de direcciones de OMS (AddressDoctor).
En caso de que la solicitud presentada sea incorrecta o no esté respaldada por la documentación adecuada, la validación en OMS fallará y no se registraran los datos de la organización en OMS.
¿Qué novedades hay en el proceso de registro de organizaciones en OMS?
Desde el 3 de noviembre de 2022, OMS permite que cualquier promotor que no esté inscrito en un registro nacional de empresas (por ejemplo, en el caso de organizaciones con sede en España, que no estén registradas en el Censo Nacional de Empresas) utilice una solicitud específica para realizar el registro en el OMS y permitir la inclusión de su información en CTIS. Para ello, se deberá de realizar la solicitud de registro incluyendo la carta de registro específica, llamada CT registration Headed letter (cuya plantilla está disponible en la página de OMS), cumplimentada la información necesaria:
- El nombre de la organización y sus datos de dirección.
- Información pública sobre la organización, por ejemplo, la disponible en fda.gov o registros locales de clínicas/médicos.
- Los datos de contacto de la organización (por ejemplo, sitio web/enlace/correo electrónico público).
- Información sobre el ensayo clínico.
De esta forma, todos los promotores que no estén inscritos en un registro nacional de empresas se podrán registran en OMS sin ser necesario que se realice un proceso de validación de su nombre. OMS mantendrá activos los registros de un promotor siempre que se pueda verificar que la información de ese promotor se está utilizando actualmente en una solicitud de un ensayo en CTIS. Dicha verificación se realizará durante la revalidación periódica de OMS, con el objetivo de garantizar que las organizaciones que han permanecido sin cambios durante más de 2 años siguen siendo válidas. Hay que tener en cuenta que cualquier promotor registrado mediante la CT registration Headed letter será desactivado si no se utiliza en CTIS como promotor o no se puede establecer contacto después de 3 intentos consecutivos a través del correo electrónico proporcionado al registrarse.
Por otro lado, desde el 3 de noviembre de 2022 OMS también ha puesto en marcha un proceso temporal para apoyar el registro de centros de ensayos clínicos que no están inscritos en un registro nacional de empresas, siguiendo el mismo proceso al anteriormente descrito para los promotores, a través del cual no hace falta validar el nombre de la organización. Esto será posible hasta que se implemente una nueva funcionalidad en CTIS, prevista para el 6 de diciembre de 2022. Esta funcionalidad permitirá el registro de los centros de ensayos clínicos directamente en CTIS.
Una vez implementado el cambio de CTIS, el equipo de OMS desactivará todos los centros de ensayos clínicos registrados mediante la CT registration Headed letter y estas organizaciones no estarán sujetas a ninguna otra comprobación periódica de revalidación. Sólo los centros que puedan ser validados por los registros nacionales de empresas permanecerán activos en el diccionario de OMS. Además, solo se registrarán nuevos centros que puedan ser validados por los registros nacionales de empresas y se rechazarán todos los registros de los centros que se soliciten mediante la CT registration Headed letter.











