Reglamento europeo de Inteligencia Artificial: oportunidad perdida o escudo protector

Si hay un sector que se está viendo impactado por el uso y desarrollo de la Inteligencia Artificial es el sanitario y por ende el de la Investigación Clínica El nuevo Reglamento es crítico para el desarrollo de la IA ya que nos jugamos mucho en cuanto a desarrollo tecnológico pero también en cuanto a respeto a nuestros derechos fundamentales
Asiste a nuestro webinar: Nuevo marco regulatorio europeo en inteligencia artificial

Bajo el título “Nuevo marco regulatorio europeo en inteligencia artificial: Implicaciones para el sector sanitario”, nuestros expertos analizarán la situación actual y el futuro inmediato. Organizado en colaboración con PMFarma, el webinar se celebrará el día 8 de febrero a las 9.30 h.
Sermes CRO se convierte en la primera CRO en adherirse al Código de Conducta de tratamiento de datos personales de Farmaindustria

Sermes CRO se adhiere al Código de Conducta de Farmaindustria que regula el tratamiento de datos personales en el ámbito de los ensayos clínicos y otras investigaciones clínicas y de la farmacovigilancia
ICH E9 y CDISC: La Fórmula Maestra para la Excelencia en la Investigación Clínica y la Gestión de Datos

Los estudios clínicos desempeñan un papel fundamental en el desarrollo de nuevos medicamentos y terapias, y en la evaluación de la eficacia y seguridad de tratamientos médicos existentes. Para garantizar la calidad y fiabilidad de los datos recopilados en estos estudios, es esencial seguir pautas y estándares sólidos. Una de las guías más importantes en este contexto es la ICH E9, emitida por la Conferencia Internacional de Armonización (ICH, por sus siglas en inglés).
Diversidad que inspira, inclusión que transforma

En el día internacional de las personas con discapacidad, 3 de diciembre, reivindicamos una vez más aquello que nos define como organización: la integración laboral de personas con discapacidad, con el fin de lograr su plena integración laboral, social, salarial y emocional.
Evaluación y aprobación de ensayos clínicos en CTIS: tiempos teóricos versus tiempos reales

Gestionar ensayos clínicos en la nueva plataforma europea de ensayos clínicos CTIS implica tener en cuenta no sólo los tiempos teóricos previstos en la EU CTR 536/2014 sino los tiempos reales que están tardando los Estados Miembros en evaluar y aprobar (en su caso) los ensayos clínicos presentados por esta vía
Los estándares CDISC: la fórmula del éxito para los datos clínicos
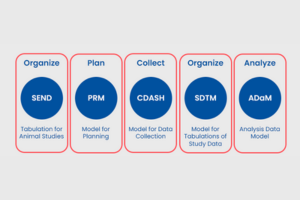
En el mundo de la investigación clínica, el intercambio y análisis de datos juegan un papel fundamental en el desarrollo de tratamientos seguros y efectivos. Los estándares CDISC (Clinical Data Interchange Standards Consortium) han demostrado ser la fórmula del éxito para lograr una armonización y estandarización efectiva en el intercambio de datos clínicos. En este artículo, exploraremos cómo los estándares CDISC han revolucionado la manera en que los datos se presentan, analizan y comparten en el ámbito de la investigación médica, mejorando la calidad de los ensayos clínicos y acelerando el progreso hacia nuevos avances terapéuticos
¡Un año más abogando por la seguridad de los pacientes!

En el día mundial de la seguridad del paciente, 17 de septiembre, recordamos una vez más, aquello que define a Sermes como CRO líder. Nos denominamos compañía Patient Centric, ya que todos y cada uno de nuestros proyectos, posicionan al paciente en el centro de la investigación.
Pago de tasas de estudios clínicos: novedades y exenciones

Conoce los cinco casos que están exentos del pago de tasas por realizar estudios clínicos, tras los cambios legislativos que afectan a las tasas sobre medicamentos, productos sanitarios, productos cosméticos y productos de cuidado personal
Transformando la investigación clínica mediante la inteligencia artificial

La incursión de la Inteligencia Artificial (IA) y el aprendizaje automático en la Investigación Clínica ha probado ser una herramienta efectiva para mejorar la eficacia de los procesos y la precisión de los resultados